加拿大、韓國、新加坡和馬來西亞新藥注冊申請監管程序
近年來,在國家政策的大力引導下,我國新藥研發領域不斷向前邁進,成果矚目。在此基礎上,中國新藥產品進入國際市場已成為必然趨勢。絲路印象海外醫藥課題組對比研究加拿大、韓國、新加坡和馬來西亞4個國家新藥注冊申請監管程序,以期為我國藥品監管程序提供切實可行的建議,促進監管體制的完善。
2016年,我國相繼頒布“重大新藥創制”、“健康中國2030”等一系列規劃及舉措。在此推動下,新藥研發領域取得了顯著成績。2016—2019年,國家藥品監督管理局藥品審評中心受理國產創新藥注冊申請數目分別為212件(77個品種)、402件(181個品種)、448件(222個品種)、528件(244個品種)。3年時間里我國創新藥注冊申請數目翻1倍。多年以來,我國一直同世界多個國家保持友好合作關系,互利往來,例如中國是亞太經濟合作組織、中國-東盟自由貿易區、上海合作組織等國際組織的成員之一。新藥在滿足國內市場需求的同時,繼而進入國際市場,期待惠及全球民眾。中國藥品進駐海外市場是新藥研發領域蓬勃發展的新成果。近年來,我國對加拿大、韓國、新加坡和馬來西亞藥品出口額整體呈增長趨勢,出口金額均在億元以上(見圖1),其中韓國是我國藥品的主要出口目的地國家之一。隨著“一帶一路”的快速實施,開發沿線國家醫藥產品市場潛力較大。
絲路印象海外醫藥課題組通過對比加拿大、韓國、新加坡和馬來西亞4個與我國有合作交流關系國家新藥注冊申請監管程序,促進國內藥企對海外注冊事務的認知,同時提煉出可供我國新藥注冊申請程序參考的借鑒點,助力監管部門完善監管體系建設。
1、新藥注冊申請申報資料格式對比
1.1 ICHCTD格式
通用技術文檔是國際人用藥品注冊技術協調會為統一藥品注冊申報資料組織而撰寫、發布的通用文件格式。CTD由5個模塊(Module,M)組成,M1是區域性要求,M2~M5則基本上是全球內容標準統一。對于國際申報的產品而言,CTD格式可提高申請人編纂注冊資料的效率,促進申請人與監管機構間的交流,有利于藥政審批規程的標準化,進而加快藥政審評審批過程。2003年7月,CTD成為歐盟和日本新藥申請的強制格式。隨著全球化標準的日益發展,如今較多國家和地區的新藥注冊申請都采用CTD格式,如中國、加拿大、新加坡、韓國等。
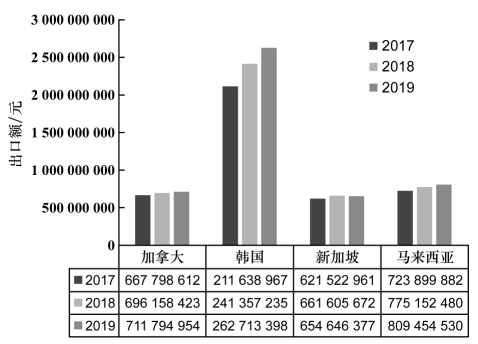
圖1 2017-2019年中國對加拿大、韓國、新加坡和馬來西亞四國的藥品出口額
CTD格式在中國的應用相對較遲。2010年9月,原國家藥品監督管理總局(CFDA)發布《化學藥品CTD格式申報資料撰寫要求》,接受化學藥品注冊分類3,4,5和6生產注冊申請的藥學部分申報資料按照CTD格式申報,同時提交電子版,可予以單獨按序審評。2018年2月1日起,化學藥品注冊分類1類、5.1類以及治療用生物制品1類和預防用生物制品1類注冊申請適用CTD格式,CTD格式應用范圍進一步擴大。2019年4月,國家藥品監督管理局(NMPA)公布CTD格式模塊1文件,于2019年7月1日開始實施。
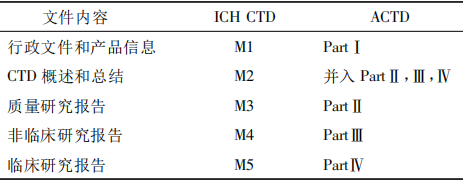
表1 ICH CTD與ACTD結構組成對比
1.2 ACTD格式東南亞國家聯盟簡稱東盟,是東南亞國家本著共同促進本地區發展而于1967年成立的聯盟組織,新加坡和馬來西亞都是其成員國。東盟為了統一成員國的藥品質量政策方針,成立了治療標準咨詢委員會和藥品生產工作小組。2012年,ASEAN提出應用于藥品注冊申請的東盟通用技術文檔要求。ACTD從ICHCTD轉化而來,但結構與其有較大的不同,具體見表1。ACTD由4部分組成,其中PartⅠ是區域性內容。新加坡和馬來西亞新藥申請都適用ACTD格式。
1.3 各國新藥注冊申請CTD格式區域性資料對比
使用CTD格式撰寫藥品注冊申報資料,各國之間最大的區別是M1/PartⅠ。通常各監管機構根據國情需要各自制定、頒布M1/PartⅠ的編寫指南,并不定時更新。2019年4月,NMPA首次發布CTD格式M1文件要求。2020年7月,國家藥品監督管理局藥品審評中心制定、更新發布模塊一文件。各國新藥注冊申請M1/PartⅠ內容在結構、文件要求等方面存在較大的差異(見表2)。值得一提的是,根據《加拿大環境保護法》,新藥注冊申請人必須向加拿大衛生部提交一份環境評估聲明。相比之下,韓國食品藥品管理局對于M1的資料要求偏向于數據方面。
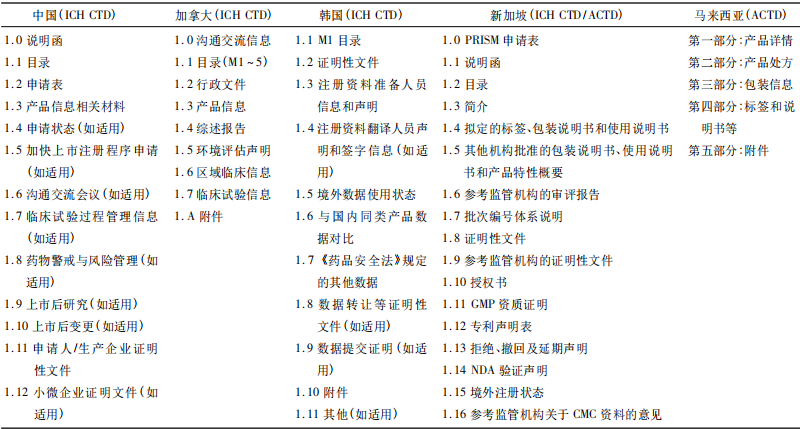
表2 各國新藥注冊申請CTD格式M1 PartⅠ資料要求對比
2、新藥注冊申請監管程序對比
2.1 加拿大新藥注冊申請監管程序
加拿大藥品注冊申請分類比較細致,主要分為新藥申請、新藥補充申請、簡略新藥申請和藥物識別碼申請等。申請人向HS遞交NDS后,遞交與知識產權辦公室在10個自然日內審核、處理基本信息后移交至審評辦公室。審評流程一般為4個階段:
①形式審查期:審查新藥申請的類別是否正確、必要資料是否齊全、費用是否繳納等信息,若缺失資料則向申請人發放形式審查期資料缺失通知函,申請人需在45個自然日提交回復。
②科學審查:一般在300個自然日內完成。
③發放科學審評通知函:新藥申請通知函分為合格通知函、發補通知函、數據資質符合通知函、不合規通知函等4種,申請人收到NOD,NOC/c-QN或者NON后需在90,30,90個自然日提交回復。
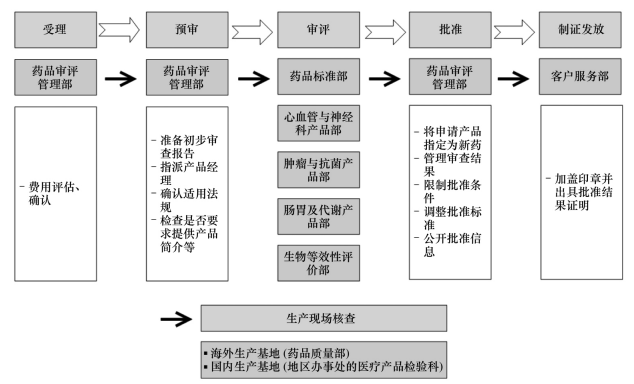
圖2 韓國新藥申請審評一般流程圖
④審查期2:審評辦公室接收并認可申請人對NON的回復后,啟動審查期2審評工作。
2012年6月,HC發布公告聲明新藥申請等多種注冊類型適用CTD格式,明確M1和M3(3.2.R)等區域性內容的要求。經過多年的發展,藥品注冊申請CTD格式的應用日趨成熟、完善,為電子通用技術文檔的實施夯實基礎。加拿大是目前已經實施eCTD格式申報的國家或地區之一。2018年,HC新藥申請等注冊類型的強制格式為eCTD;2019年,HC進一步擴大eCTD格式的適用范圍。eCTD格式申報資料通過CESG電子門戶遞交。目前,HC所有的注冊申請資料均不接受紙質遞交,非eCTD格式申報資料可使用光盤、U盤等物理介質遞交。
2.2 韓國新藥注冊申請監管程序
韓國藥品注冊申請分為新藥申請、仿制藥申請等。其國家食品藥品安全評估研究院是韓國藥品審評機構,新藥申請審評審批程序包括以下5個步驟(見圖2):
①受理:費用評估、確認。
②預審:確認提交數據是否符合要求、準備初步評估報告、指派產品經理等。③審評:審查數據的安全性和有效性、產品規格、檢測方法、主文件檔案、證明性文件(進口藥物)等。
④批準。

表3 新加坡NDA申報資料要求
⑤制證發放。含DMF審查的新藥申請審評工作時限為120d,反之則為90d。新藥申請的注冊費用按照申請方式計費,線上申請的費用為6177850韓元(約合5232美元),郵寄或現場申請的費用為6828150韓元(約合5783美元)。新藥申請適用的加快上市注冊程序有預先審查和快速審查2種。
2.3 新加坡新藥注冊申請監管程序
新加坡衛生科學局是其藥品監管機構,藥品注冊申請類型分為新藥申請(NDA)和仿制藥申請2種類型,NDA包括NDA-1,NDA-2和NDA-3。新藥的首次申請按NDA-1申報,獲批后改變劑型、處方、包裝規格、增加適應證等申請按NDA-2申報,改變規格則按照NDA-3申報。NDA適用的審評程序有3種:①完整審評程序(fullNDA):未被任一藥品監管機構批準的新產品。②簡略審評程序(abridgeDNDA):經至少1個藥品監管機構批準的新產品。
③驗證審評程序:經相關藥品監管機構批準的產品,相關藥品監管機構包括澳大利亞治療產品管理局、HC、美國FDA、歐洲藥品管理局、英國藥品和保健品產品監管局。不同的審評程序對申報資料的要求不同,完整審評程序要求的資料最多,見表3。NDA審評程序工作時限由形式審查期和審評期2個階段構成,形式審查期為50個工作日,完整、簡略、驗證審評程序的審評期分別為270,180,60個工作日。不同NDA類型的評估費用不同,見表4。
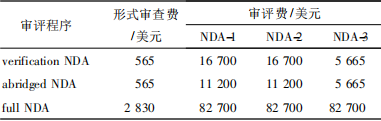
表4 新加坡NDA費用明細表
與國際現行做法一致,新加坡NDA申報資料格式為CTD格式。與其他國家不同的是,HSA接受的CTD格式有2種:ICHCTD和ACTD。新藥申請CTD格式申報資料為電子遞交,有2種方式,一是全部資料通過PRISM門戶提交;二是M1/PartⅠ文件經PRISM門戶傳輸,其余文件使用CD/DVD光盤提交。2.4 馬來西亞新藥注冊申請監管程序
馬來西亞國家藥品管理局是其藥品監管機構,NPRA監管的藥品類型分為新藥、生物制品、仿制藥、保健品和天然產品等。新藥申請分為2類:一類是含單一活性物質的新產品,另一類是已注冊產品的新組合類型或改變新產品的劑型、規格、給藥途徑等(hybrid)。新藥申請申報資料適用ACTD格式,不同的申請類型資料要求不同,見表5。新藥申請的審評程序有3種:
①完整審評程序。
②有條件批準的完整審評程序。

表5 馬來西亞新藥申請資料要求和審評時限
③簡化審查或驗證審查的完整審評程序。新藥注冊申請的費用由產品所含的活性物質決定,單一活性物質產品需4000林吉特(約合956美元),含2種或多種活性物質產品需5000林吉特(約合1194美元)。馬來西亞藥品注冊申請所有申報資料采用線上遞交的方式,通過QUEST系統提交。注冊申請受理審核通過后,申請人再按照要求提交CD、紙質副本資料。2.5 我國新藥注冊申請監管程序
2020年3月,NMPA發布《藥品注冊管理辦法》,此后相關配套文件陸續出臺,藥品注冊管理愈加規范。我國藥品申請類型涵蓋新藥申請、仿制藥申請、補充申請、再注冊申請等。2020年6月,NMPA發布公告要求化學藥品和生物制品的新藥申請從2020年10月1日起按照CTD格式準備申報資料。國產新藥申請費用為43.2萬元(約合61857美元),進口新藥申請費用為59.39萬元(約合85038美元)。新藥申請審評工作時限一般為200個工作日(見圖3),納入優先審評程序的工作時限為130個工作日。2020年7月1日,新版《藥品注冊管理辦法》正式實施后,將原來的審評、核查和檢驗由“串聯”改成“并聯”,縮短審評時限,保證總時限可控。
3、我國新藥注冊申請程序可資借鑒點
3.1 擴大電子遞交的范圍
目前我國藥品注冊申請電子遞交的覆蓋面較窄,到目前為止只有原料藥、輔料、包材等申請類型采用光盤遞交的方式,絕大部分申請類型如新藥申請、仿制藥申請等還是采取傳統的紙質遞交方式。藥品注冊申請申報資料實行“2+1”模式,即2套完整申請資料與1套綜述資料。相比于紙質資料,電子提交具有節約資源、節省空間、便于審評交流等優點。我國藥品監管有關部門應加快出臺電子遞交的政策,全面實現注冊申請資料的電子化提交,減少申請人申報資料準備時間,進一步與國際監管接軌。對于一些必要的證明性文件,如公證認證文書等,為保證材料的真實性,可執行線下紙質遞交的方式。

圖3 我國新藥申請審評一般流程圖
3.2 促進與國際藥品監管機構間的交流,增強相互認可度對于經過相關藥品監管機構批準的藥品,HSA實行的是簡略或驗證審評程序,此類程序的申報資料要求、注冊費用以及審評工作時間都低于完整審評程序,大大加快了藥品上市時間。但是,NMPA目前并不屬于新加坡“相關藥品監管機構”成員。未來我國藥監部門與國際藥品監管機構開展更多交流合作,加深相互了解,提升我國研發能力,帶動藥監管理能力,增強國際藥品監管機構對NMPA批準藥品的認可度,為國產藥品的國際注冊爭取“綠色通道”。希望通過國際合作交流,形成我國監管機構的“綠名單”,對于符合我國藥品監管理念的機構,予以一定的認可,簡化其批準產品在我國的注冊申請程序,一方面能減輕審評人員的工作負擔,另一方面可以加快產品上市時間,滿足人民的醫療用藥需求。
4、總結
我國新藥研發領域發展態勢良好,國產新藥參與國際市場競爭是下一步進展走向。促進與國際藥品監管機構間的溝通,建立相互認可合作體系,是國產新藥走出國門的良好助力。 報告推薦:
后疫情時代加拿大投資環境及發展潛力報告
后疫情時代加拿大母嬰用品行業投資前景及風險預測報告
后疫情時代加拿大能源行業投資前景及風險預測報告
后疫情時代加拿大零售行業投資前景及風險預測報告
后疫情時代加拿大電力行業投資前景及風險預測報告
后疫情時代加拿大汽車行業投資前景及風險預測報告
后疫情時代加拿大酒店行業投資前景及風險預測報告






 在線客服
在線客服
 官方微信
官方微信

 客服電話
客服電話



